「認知症について」
昨年11月、星友館において認知症に関する文化講演をさせていただきました。
講演内容の一部をまとめ、また追記しながら、認知症(主にアルツハイマー型認知症)について説明してみたいと思います。
まずは最近物忘れが気になり出した方のために、老化による物忘れと認知症による物忘れの違いを説明します。
老化による物忘れの場合は①体験の一部を忘れる、②ヒントを与えられると思い出せる、③物忘れに対して自覚があります。一方認知症による物忘れの場合①体験全体を忘れる、②ヒントを与えられても思い出せない、③物忘れに対して自覚がありません。
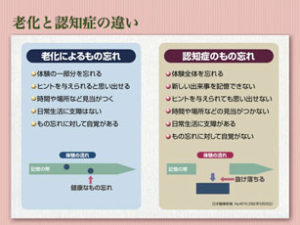
よって非常に簡単な区別方法ではありますが、ご自分で「最近物忘れが多くなった」と感じられている場合は”老化による物忘れ”であり、人から物忘れを指摘されるものの「そんなことはない」と言ったり、「あのときは・・・」などと言い訳を繰り返す場合は認知症である可能性が高いと言えます。つまり物忘れが気になり出した貴方が認知症である可能性は低いと言うことですね。どうですか、安心できましたか?
では後は気楽に読んで下さい。
どこへ行っても認知症とアルツハイマー病(またはアルツハイマー型認知症)の違いをよく聞かれます。実は認知症というのは病名ではなく症状名なんです。つまり腹痛や頭痛といったものと同じです。腹痛を引き起こす原因に胃潰瘍・胃炎・ストレスや食べ過ぎなどがあるように、認知症を引き起こす原因にアルツハイマー病・多発性脳梗塞・レビー小体病などといった幾つもの病気があり、アルツハイマー病によって引き起こされた認知症をアルツハイマー型認知症と呼びます。

さて現在、認知症の患者さんは年間約6万人ずつ増加しています。年齢と共にその割合は高くなっていき、85歳以上ではおおよそ3人に一人は認知症であると言われています。中でもアルツハイマー型認知症が最も多く、認知症の約50%を占めています。この割合も年々高くなってきています。
ではアルツハイマー病というのはどんな病気なのでしょうか?いまだ完全には原因究明されていない病気で、脳萎縮が起こり主に理解力が低下し、これらが進行していきます。
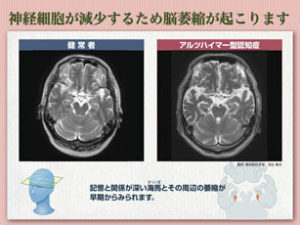
もちろん物忘れも起こるのですが、理解力が低下するためにご自分の変調に気付くことが出来なくなります。
アルツハイマー病は1906年ドイツのアロイス・アルツハイマー氏が進行性の記憶障害や妄想を引き起こし死亡された55歳の女性を報告したことに始まります。①大脳皮質神経細胞の減少による大脳萎縮、②老人斑と呼ばれるシミのような多発する異常構造、③繊維状組織の蓄積が特徴的な病理学的異常所見であるとアルツハイマー氏は報告しています。その後しばらくの間、上記病理所見が軽度である老年性認知症(と当時は呼ばれていました)とアルツハイマー型認知症は別々の病気であると考えられてきました。しかしこれらは「質的な違い」ではなく、上記病理所見の「量的な違い」であるため、1970年代後半からはすべて発症時期の異なるアルツハイマー病と考えられる様になりました。この変革により”年をとった事による認知症”というものは無くなり、そのほとんどがアルツハイマー型認知症であると認識されるようになっています。このことにより治療対象となる患者さんが飛躍的に増加し、アルツハイマー病の研究に拍車がかかりました。
一方、同時期にはパーキンソン病の研究が少しばかり先行していました。そしてパーキンソン病はドパミンという神経伝達物質の減少により症状が引き起こされていると判明します。アルツハイマー病も同様の病態ではないかと考える研究者がいても不思議ではありません。結果、アルツハイマー病の脳内ではアセチルコリンという神経伝達物質が減少していることが発見されました。このアセチルコリンを分解する酵素が見つかり、この酵素阻害薬への研究に発展し、現在のアルツハイマー型認知症治療薬へと繋がっていきました。また以上の経過があるため、日本における現在の認知症保険適応薬はすべてアルツハイマー型認知症にのみ適応が通っており、その他の認知症は保険適応外となっています。そしてこれらの治療薬により一時的に症状が軽減する事はあるものの、進行を止めることは出来ず、進行速度を緩やかにする効果しか認められません。
結局、このアセチルコリン減少は症状の原因ではあるもののアルツハイマー病そのものの原因ではないと考えられるようになり、真犯人捜しが始まりました。次に注目されたのは老人斑です。老人斑にはアミロイドβ(ベータ)の蓄積が認められます。しかし、アミロイドβは誰の脳内であっても生成されている物質であり、通常分解酵素が存在するため脳内には蓄積しません。しかし遺伝性アルツハイマー病患者さんにおいてアミロイドβ分解酵素の欠如・減少が確認されたことにより、この分解酵素の減少や機能低下がアルツハイマー病の原因であると考えられるようになりました。
現在、このアミロイドβ分解酵素犯人説が学説の主流です。ちなみにこの分解酵素を持たないマウスを育成していくと明らかな学習能力低下を確認できるようになります。またこれらの研究によりアルツハイマー病発症の10年以上前より老人斑が増加していることが判ってきました。解剖することなく老人斑もしくはアミロイドβ蓄積が検出できるようになれば、発病する数年前にアルツハイマー病になることが分かることになります。もちろん同時に画期的な治療薬が開発されることが条件となりますが、アルツハイマー型認知症の治療は劇的な変化を起こすかもしれません。またアルツハイマー病以外で認知症を引き起こしている病気にレビー小体病やピック病などが有ります。これらの病気でも老人斑(アミロイドβの蓄積)が認められるため、アルツハイマー病と同じ原因で引き起こされる、単に中心となる脳の場所が違う「部位の違い」なだけの同じ疾患群と判断されるようになるかもしれません。現に前述のアセチルコリン分解酵素阻害薬は諸外国において他の認知症にも適応が広がっています。同じ疾患群との認識が確立されたならば、次期治療薬の適応はアルツハイマー型認知症だけにとどまらず、脳血管性認知症を除いたすべての認知症に広がり、一気に認知症治療が変わると考えられます。
現在、アミロイドβの検出として血液検査や脊髄液検査が行われていますが、血液検査では感度が弱く、一方脊髄液採取には多少の危険性を伴い、いずれも脳内アミロイドβの蓄積を捕らえられているのか不明であるため、まだまだ研究段階を脱していません。また老人斑検出としてPET検査やMRI検査が行われています。PET検査は保険適応外の特殊な試薬を静脈注射し検査するため1検査当たり数十万円かかる事、微量ではあるが内部・外部双方の放射線被曝があること、また解像度が悪い検査であるためある程度進行した患者さんでなければ検出できないことなどの問題があります。
一方、MRI検査は解像度が高く、放射線被曝もないのですが、7テスラMRI(テスラは磁場強度単位)においても長時間検査が必要であり、より短時間での検査のためには専用の造影剤開発が待たれるところで、現時点ではいまだ実験段階と言わざるを得ません。
一方、アセチルコリンの原料となり、アセチルコリンそのものを増加させることが出来るいくつかの物質が見つかっています。これらは症状改善に有効で有ることが判ってきており、健康食品(サプリメント)として入手可能です。またマウスなどの実験において老人斑や蓄積アミロイドβを分解減少させる能力を持つ物質もいくつか見つかっています。上記検出検査が未確立であるため人においての効果判定はもっぱら症状によるものとなっています。結果、実際に老人斑が減少しているかは未確認であると言わざるを得ませんが、これらの物質もサプリメントとして入手が可能です。これらは製薬としての開発は計画されておらず、今後もサプリメントとしてのみ販売されていくものと考えられます。また各製薬会社も老人斑やアミロイドβについての研究を当然行っており、アミロイドβの分解能力を持った薬品が現在欧米においてフェーズⅡ(患者さんを対象とした安全性・効果確認試験)の治験段階になっています。メーカーとしては今後10年以内の販売を計画しています。
次に、生活習慣病と認知症の関係について説明していきます。生活習慣病と言えば高血圧症・糖尿病・脂質代謝異常(高脂血症)・高尿酸血症・ニコチン依存症(喫煙)などが挙げられ、いずれも脳卒中の原因になるものです。多発性の脳梗塞や脳出血は認知症を引き起こす(脳血管性認知症)ので、当然これらの生活習慣病は認知症の原因となるものです。よって認知症になる確率を下げるためにはこれらの生活習慣病の充分な治療を行う必要があることは自明の理ですが、脳卒中とは直接関わりがない状態でも上記疾患が認知症の発症と関係があると言うことが判ってきています。以下そのことについてお話しします。
まず、高血圧症患者さんには老人斑が多い事が判っています。また高血圧症の特徴としてこの老人斑が血管周囲に多い事も判っています。また未治療高血圧の場合は治療患者さんより明らかに老人斑が多い事も判明し、高血圧が老人斑を増加させる要因であることは疑いの余地がありません。また、各種の大規模試験において複数の降圧剤が認知機能低下抑制に効果あることが確認されており、中にはアルツハイマー型認知症の発症を抑制したと結論付けたものもあります。
ところで、血圧を下げると脳血流はどうなるのでしょうか。元来脳の血管には自動調節機能があるため、ある程度の血圧変動では脳血流はさほど変化しません。つまり血圧が下がれば血管が拡張することで血流量を確保し、血圧が上がると血管が収縮し血流量が増えないようになっています。ところがこの自動調節機能の限界を超えて血圧が変動すると血流量に変化が起こるようになります。これが起立性低血圧症による失神であったり、高血圧性脳症による意識障害の原因です。このような自動調節機能範囲外の状況はさておき、範囲内においては大きく変化しない様になっているのです。しかし、これは短期間での話で、長期にわたる血圧変化と脳血流を詳しく調べていくと興味深い結果が得られます。脳卒中を起こされた44名の患者さんにおいて降圧治療前と治療後における脳血流量を調べた研究があります。治療前は140〜150台/90〜100台の血圧を8週間の降圧治療により120〜130台/70〜80台へと低下させています。結果、脳卒中障害側脳での血流は平均35→40(ml/min/100g)へと増加しており、非障害側脳においても平均45→50(ml/min/100g)に増加しています。
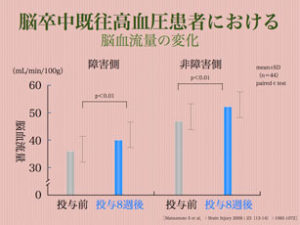
また、同時に調べたMMSE(認知機能評価テスト;30点満点)でも平均23(15〜27)が平均27(21〜30)へと上昇しており、認知機能の改善も確認されています。更に各種降圧剤間においても認知機能への影響を比較調査されています。高血圧症を発症していない認知症誘発マウスにおいて各種降圧剤を投与し学習能力を調べた試験において、Ca(カルシウム)拮抗剤では学習能力向上は確認されず、ARB(アンジオテンシンⅡ受容体拮抗薬)において学習能力の改善が認められています。中でも脂溶性ARBにおいては非認知症マウスと同等の学習能力を発揮する事が確認されています。
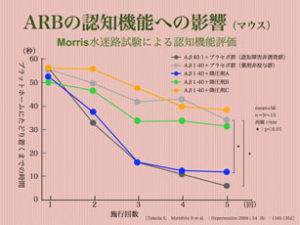
決して高血圧症がないのに降圧剤を服用する必要はありませんが、高血圧症に対しては充分な降圧治療が認知症予防の観点からも勧められますし、中でもARBによる治療がお勧めです。
次いで糖尿病です。ロッテルダム研究という非常に大規模な前向き研究があります。6370名を2年間追跡調査したもので、アルツハイマー型認知症の発症率は糖尿病群で非糖尿病群の1.9倍となり、インスリン治療群では非糖尿病群の4.3倍であったという結果でした。また国内では久山町研究があります。826名を15年間前向き調査したもので、耐糖能異常(糖尿病+予備群)があると、脳血管性認知症は2.5倍、アルツハイマー型認知症は3.0倍起こりやすかったと結論づけています。
喫煙も認知症の危険因子です。もちろん喫煙者の脳卒中危険率は非喫煙者の1.5倍ですので、脳血管性認知症の危険性が高いことは当然です。実はそれ以上にアルツハイマー病の危険率が高いとの報告が相次いでいます。代表的な報告は、55歳以上の認知症を認めない6868名に対し平均7.1年間追跡調査したものです。結果、喫煙者は非喫煙者に対して、すべての認知症で1.47倍、アルツハイマー病に限ると1.56倍発症していました。また複数の研究結果をメタ解析したもの(2007年発表)で、現在喫煙者は非喫煙者に対しアルツハイマー病で1.79倍(1.43〜2.23)、脳血管性認知症は1.78倍(1.28〜2.47)、過去喫煙者(喫煙歴はあるものの現在は禁煙している人)に比較しても現在喫煙者のアルツハイマー病発症率は1.70倍になっています。
以上より高血圧症や糖尿病の治療をすることや禁煙により認知症の発症をかなり抑えられると言えますので、決して放置せず、出来るだけ早期に充分な治療を開始する必要があります。

